ACARA 2
ENERGI POTENSIAL SEBAGAI FUNGSI SUDUT TORSI
1. Tujuan
·
Menghitung
energi potensial sebagai fungsi sudut torsi pada ikatan tunggal.
·
Menggambarkan
kurva energi potensial terhadap variasi sudut torsi pada konformasi ikatan
tunggal.
·
Menentukan sudut
torsi yang memberikan nilai energi potensial paling rendah.
2. Dasar Teori
Salah satu
prinsip utama dari energi potensial adalah hukum kekekalan energi, yang
menyatakan bahwa energi tidak dapat diciptakan maupun dihancurkan. Energi yang
dikeluarkan untuk mengangkat suatu objek atau memampatkan pegas tidak hanya
hilang, itu adalah “disimpan” sebagai energi potensial. Hal ini kemudian
dilepaskan sebagai energi kinetik oleh gaya pemulih. Masukan energi sama dengan
keluaran energi, tidak ada keuntungan atau kerugian energi secara keseluruhan.
Torsi merupakan hasil dari gaya pada
media yang memiliki sudut (angular momentum) sehingga memiliki sudut relatif
yang mempengaruhi besarnya gaya yang dihasilkan dalam suatu masa (Fiktor, 2012). Energi
torsi dalam mekanika molekul lebih dimaksudkan untuk digunakan mengoreksi suku
energi yang tersisa daripada untuk menggambarkan proses fisika. Energi torsi
mewakili jumlah energi yang harus ditambahkan atau dikurangi dari suku-suku
energi rentangan + energi beng-kokan + energi interaksi tidak berikatan, agar
energi total sesuai dengan eksperimen atau hasil kalkulasi mekanika kuantum untuk
suatu model sudut dihedral (Kasmui, 2013).
Panjang ikatan dan sudut torsi yang
terbentuk ini mempengaruhi energi konformer dari masing – masing bentuk. Teori
regangan Baeyer (Baeyer’s strain theory)
menyebutkan bahwa senyawa siklik seperti halnya sikloalkana membentuk cincin
datar. Bila sudut-sudut ikatan dalam senyawa siklik menyimpang dari sudut
ikatan tetrahedral (109,50) maka molekulnya mengalami regangan.
Makin besar penyimpangannya terhadap sudut ikatan tetrahedral, molekulnya makin
regang, dan berakibat molekul tersebut makin reaktif. Yang membedakan
konformasi adalah sudut yang dibentuk antara atom C satu dengan atom C yang
lain, sudut torsi yang dibentuk antara atom C yang satu dengan yang lain serta
energi dari setiap bentuk konformasi yang berbeda (Annur,2013).
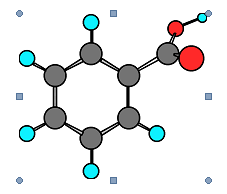
Asam
benzoat berdasarkan bukti-bukti penelitian menunjukkan mempunyai toksinitas
yang sangat rendah terhadap manusia dan hewan. Pada manusia, dosis racun adalah
6 mg/kg berat badan melalui injeksi kulit tetapi pemasukan melalui mulut
sebanyak 5 sampai 10 mg/hari selama beberapa hari tidak mempunyai efek negatif
terhadap kesehatan (Luthfi, 2009). Berikut
struktur dari asam benzoat :
Gambar 1. Asam Benzoat
3. Metodologi
Penelitian
3.1.
Alat
Alat
yang digunakan adalah software Hyperchem
professional ver. 7.0, laptop model
DELL kapasitas RAM 2 Gb Intel CORE Duo
3.2.
Cara kerja
Prosedur dari percobaan ini yaitu, pertama masuk
program hyperchem. Menetapkan cursor sebagai draw (menggambar) pada menu,
setelah itu digambar rumus struktur asam benzoat. Pilihlah ab initio dengan minimum basis
set untuk perhitungan, selanjutnya diganti cursor sebagai select (memilih) dan memilih pemilihan
untuk atom dan pemilihan lebih dari satu kali (multiple) pada menu “select”.
Setelah itu pilihlah empat atom di sekitar ikatan tunggal antara C (benzene)
dengan C (gugus asam karboksilat) yaitu C-C-O-H sehingga terbentuk susut torsi.
Setelah dipilih kemudian diklik “potensial” pada menu “compute”, lalu diisi
variasi nilai sudut torsi awal = 00 dan akhir= 3600 serta
rentang/step=100. Setelah itu ditentukan nilai sudut torsi yang
memiliki energy paling rendah berdasarkan kurva potensial terhadap sudut torsi
C-C-O-H dalam struktur asam benzoate.
4. Hasil dan
Pembahasan
4.1.
Data
Pengamatan
Setelah
melakukan percobaan ini data yang didapat yaitu, terbentuknya kurva energi
potensial dari senyawa asam benzoat. Berikut adalah kurvanya :
4.2.
Pembahasan
Energi potensial
adalah energi yang tersimpan karena posisi. Hal ini dapat dianggap sebagai
energi yang “tersimpan” oleh sistem fisik. Hal ini disebut potensial karena,
dalam bentuk yang sekarang, tidak melakukan pekerjaan apapun atau menimbulkan
perubahan dalam lingkungannya. Memang, bagaimanapun, memiliki potensi untuk
dikonversi menjadi berbagai bentuk energi, seperti energi kinetik. Satuan
standar untuk mengukur energi tersebut adalah dengan joule.
Kimia
komputasi adalah cabang kimia yang menggunakan hasil kimia
teori yang diterjemahkan ke dalam program
komputer untuk menghitung sifat-sifat molekul
dan perubahannya maupun melakukan simulasi terhadap sistem-sistem besar
(makromolekul seperti protein atau sistem banyak molekul seperti gas, cairan,
padatan, dan kristal cair), dan menerapkan program tersebut pada sistem kimia nyata.
Contoh sifat-sifat molekul yang dihitung antara lain struktur (yaitu letak
atom-atom penyusunnya), energi dan selisih energi, muatan, momen dipol,
kereaktifan, frekuensi getaran dan besaran spektroskopi lainnya. Simulasi
terhadap makromolekul (seperti protein dan asam nukleat) dan sistem besar bisa
mencakup kajian konformasi molekul dan perubahannya (mis. proses denaturasi
protein), perubahan fasa, serta peramalan sifat-sifat makroskopik (seperti
kalor jenis) berdasarkan perilaku di tingkat atom dan molekul. Istilah kimia
komputasi kadang-kadang digunakan juga untuk bidang-bidang tumpang-tindah
antara ilmu komputer dan kimia (Intan,2011).
Cara
kerja dilakukan dengan memasuki program Hyperchem terlebih dahulu, lalu gambarkan
struktur asam benzoat sehingga menghasilkan struktur berikut :
Gambar 1.
Asam Benzoat
Selanjutnya klik set up kemudian
tentukan ab initio dengan minimum basis set. Selanjutnya memilih atom yang
akan dihitung sudut torsinya dengan menggeser cursor ke arah select (memilih), lalu pilih empat atom
di antara atom C (benzene) dengan C (gugus asam karboksilat) yaitu atom C-C-O-H
sehingga membentuk sudut torsi seperti yang terdapat dalam gambar berikut :
Gambar 2. Asam Benzoat
Setelah dipilih atom-atomnya, klik
“potensial” pada menu “compute”, lalu isi variasi nilai sudut torsi awal (initial bond angle) = 0o dan
sudut torsi akhir (final bond angle)
= 360o dengan rentang (step)
= 10o. Lalu ditunggu beberapa saat hingga muncul kurva potensial
terhadap sudut torsi
Setelah
perhitungan selesai, maka akan muncul kurva energi potensial terhadap sudut
torsi seperti tertera dalam grafik berikut
:
Kurva 1.
Energi Potensial terhadap Sudut Torsi
Dari grafik di atas dapat diketahui
bahwa energi potensial C-C-O-H pada sudut torsi 0o sebesar -259.133,5 kkal/mol, kemudian
energi potensial pada sudut
torsi 90o sebesar
-259.130,5 kkal/mol, sedangkan
energi potensial pada sudut torsi 180o sebesar -259.140 kkal/mol,
lalu energi potensial pada sudut torsi 270o sebesar -259.130,5 kkal/mol, dan energi potensial pada sudut
torsi 360o sebesar -259.133,5
kkal/mol.
Berdasarkan
grafik di atas dapat diketahui bahwa sudut torsi yang memiliki energi paling
rendah adalah sebesar 180o. Sudut torsi 180o dibentuk
dari ikatan antara C benzene dengan C karbonil (C-C-O-H). Energi terkecil ini
disebabkan karena C-C-O-H ini berfungsi sebagai pusat putaran. Jika dihubungkan
dengan pintu, maka C-C-O-H ini berfungsi sebagai engsel yang terus bergerak
jika ada dorongan dari lingkungan sekitar. Dorongan yang terus-menerus membuat
ikatan C-C-O-H (sudut torsi 180o) memiliki energy potensial terkecil
dibanding ikatan atom-atom yang lain.
Hubungan energi potensial dengan perbedaan sudut torsi bisa dijelaskan dengan
teori stereo kimia organik. Hubungannya dapat dilihat pada gambar berikut :
Gambar 3. Hubungan antara Sumbu Putar
Rotasi dengan Energi
Kurva 2. Hubungan Energi dengan Sumbu
Putar Gugus dalam Suatu Senyawa
Dari gambar
diatas terlihat hubungan antara sumbu putar terhadap energi dalam senyawa kimia.
Pada gambar a mempunyai energi yang paling rendah, hal itu karena gugus metil
pada gambar a saling berjauhan atau mempunyai jarak yang paling jauh sehingga
tolak-menolak antar gugus sangat kecil. Tolak menolak inilah yang menyebabkan
energi dari gambar a paling rendah. Begitupula dengan sudut torsi pada Asam
Benzoat yang memiliki sudut 180o. Karena tolak menolak antara gugus
elektronegatif pada asam benzoat sangat kecil pada sudut 180o
sehingga mempunyai energi yang paling rendah.
5.
Kesimpulan
1. Energi
potensial terendah sebagai fungsi sudut torsi
pada ikatan tunggal C-C-O-H asam benzoat yaitu sebesar -259.140 kcal/mol.
2. Kurva
energi potensial terhadap variasi sudut torsi pada konformasi ikatan tunggal
C-C-O-H asam benzoat yaitu :
3. Sudut
torsi yang memberikan nilai energi potensial paling rendah yaitu pada 180°.
DAFTAR
PUSTAKA
Dendy, 2012, Analisis Menggunakan Hyperchem
ab-initio, http://dendypunya.blogspot.com/2012/01/analisa-menggunakan-hyperc
hem-ab-initio.html, diakses 13
Desember 2014.
Fiktor,
2012, PengaruhTorsi dan Horsepower pada Kendaraan, http://entertainment123fisikaku.wordpress.com/2012/11/27/pengaruh-torsi-dan-horsepower-pada-kendaraan/, diakses 13 Desember 2014.
Intan, 2011, Pengertian
Komputasi,http://intanmauliiwari.blogspot.com, diakses 13 Desember 2014.
Kasmui, 2013, Kimia Komputasi,
http://kimia.unnes.ac.id/kasmui /komputasi /mm.html, diakses 13 Desember 2014.
Lutfi
, Achmadz, 2009 , Asam Benzoat, http://www.chem-is-try.org/materi-kimia/kimia-
lingkungan/zat-aditif/asam-benzoat/ , diakses 13 Desember 2014
















Posting Komentar